本篇目录:
为什么绝热过程压强下降比等温过程快
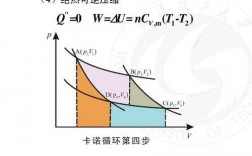
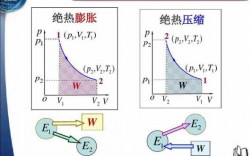
1、在等温可逆膨胀过程中系统对环境做的功比绝热可逆膨胀做的功大。绝热膨胀是指与外界没有热量交换,但等温可逆膨胀跟外界是有联系的,可以进行热量交换。绝热可逆膨胀这个过程中气体体积增大,压强降低,因而温度降低。
2、绝热自由膨胀过程的状态参量温度T不变,体积V增大、压强P减小 气体向真空自由膨胀过程中不受外界阻力,所以外界不对气体做功。
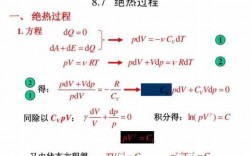
3、能量的释放不同:温压缩产生热量立即释放。绝热压缩指产生热量不释放,不损失。内能变化不同:等温压缩内能不变。绝热压缩内能增加。温度的变化不同:等温压缩,温度不变,向外散热。
4、气体做功不同。绝热可逆膨胀:气体对外界做功,气体膨胀。根据热力学第一定律,可证明这是等熵过程,在这个过程中气体体积增大,压强降低,因而温度降低。等温可逆膨胀做的功大于绝热可逆膨胀做的功。
为什么绝热下进行上述反应,容器中的温度比恒温容器中的温度高
性质不同:绝热就是不导热的,恒温就是温度不变。含义不同:恒温,说明器壁具有良好的导热性,能够及时进行容器内外的热交换,所以使容器内保持恒温。绝热,就是器壁不导热,如反应放热,容器内温度就会逐渐升高。
你要注意这是个绝热的容器。所以反应的放热和吸热容器的温度也会变。3温度明显比1高,B错。1号和2号在恒温下才会构成互补关系,现在一个放热一个吸热,根据勒夏特列原理。两个都不能达到恒温反应的效果。
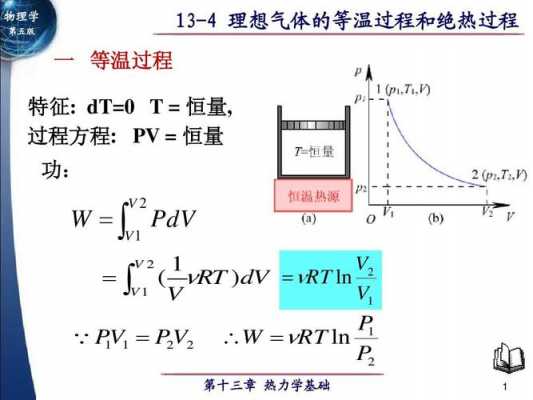
化学反应平衡中,恒温恒容对于反应平衡常数没有影响,而绝热恒容则有影响。
如是放热反应,随着反应的进行,容器中温度升高,反应速率加快,化学平衡向吸热方向移动。如是吸热反应,容器中温度降低,反应速率减慢,化学平衡向放热方向移动。
反应是放热。所以绝热装置中,温度要高。对于这个反应,温度越高,平衡越想逆方向。转化率就低。
绝热和等温有什么区别?
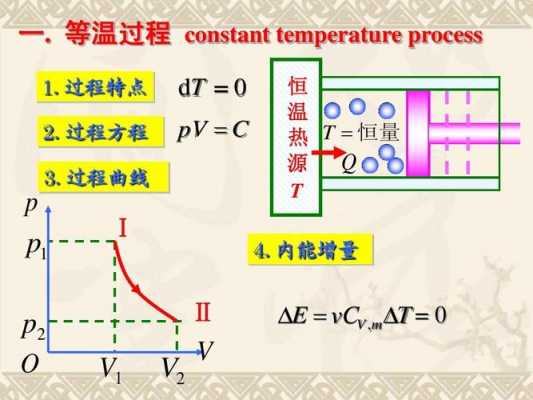
1、绝热膨胀是指与外界没有热量交换,但等温可逆膨胀跟外界是有联系的,可以进行热量交换。绝热可逆膨胀这个过程中气体体积增大,压强降低,因而温度降低。但等温可逆膨胀就是温度是不会发生变化。
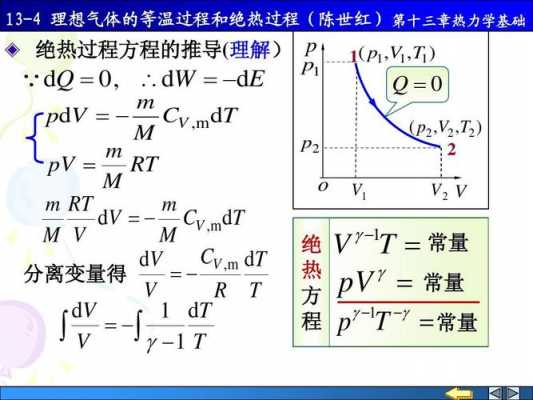
2、等温过程和绝热过程的区别的区别如下:等温过程是过程中温度保持不变,可能有吸热或放热。绝热过程是过程中没有吸放热,但温度可能变化。
3、温度环境不一样 等温可逆膨胀指的在反应过程中温度是恒定不变的,而绝热可逆膨胀指的是内部反应与外界没有热量交换。气体做功不同 绝热可逆膨胀:气体对外界做功,气体膨胀。
到此,以上就是小编对于为什么绝热过程q=0的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏