本篇目录:
- 1、绝热过程的公式是什么?
- 2、绝热过程功的计算
- 3、绝热过程是什么意思
绝热过程的公式是什么?
PdV+VdP=nRdT、dQ=dU+dW=0、pV^(Cp/Cv)=const。绝热过程是一个绝热体系的变化过程,绝热体系为和外界没有热量和粒子交换,但有其他形式的能量交换的体系,属于封闭体系的一种。绝热过程有绝热压缩和绝热膨胀两种。
绝热过程是一个绝热体系的变化过程,其三个公式是指E=NCvT、dW+dE=0、dT=[pdV+Vdp]/NR,即体系与环境之间无热量交换的过程。

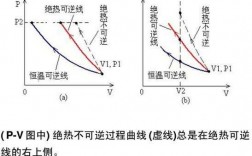
W=-p外 (V2-V1),这个式子无论是否可逆都可以使用。系统整个过程中的中间状态不一定都是平衡态,系统的压强可以时时不同(没有一个确定的p),但W=-积分号(p外dV)=-p外积分号(dV)=-p外(V2-V1)。
公式如下图:关于理想气体,有可逆绝热过程方程,在满足理想气体、绝热、可逆这三个基本条件,才能使用该方程。
绝热过程表达式: pv^k=C p:压力 v:容积 k绝热指数,对于空气为k=4根据绝热过程的变化规律,由压容图,经积分求得。
绝热过程功的计算
原因:由热力学第一定律:△U=Q+W,真空绝热膨胀,绝热Q=0,做功w=§pdv,有真空绝对压强p=0,所以做功为0。

其中V1易求,p1V1=nRT1,V2=nRT2/p2。理想气体有ΔU=nCv,m(T2-T1),绝热过程有 ΔU=W,则nCv,m(T2-T1)=-p外(V2-V1)=-p外(nRT2/p2-V1)。据此求出T2,进而求出V2,代回功的表达式即可。
绝热过程的三个公式:PdV+VdP=nRdT,dQ=dU+dW=0,dU=nCvdT。绝热方程是利用热力学第一定律和理想气体状态方程在准静态条件下导出的,绝热方程的应用必须满足理想气体条件和准静态条件。
绝热过程就是在状态变化过程中,系统与环境之间没有热交换的过程。实际上真正的绝热过程是不存在的,但是可以把在隔热性能较好的密闭容器内发生的状态变化过程近似看作绝热过程。
绝热过程是什么意思
1、在与外界没有热量交换情况下所进行的过程称为绝热过程。

2、在物理化学中,绝热通常指绝热过程(adibatic process),这是一种热力学过程,其中系统中没有热量进出,即系统与外界不进行热量交换,而只进行功交换。
3、绝热方程是一个绝热体系的变化过程,即是指任一气体与外界无热量交换时的状态变化过程,是在和周围环境之间没有热量交换或者没有质量交换的情况下,一个系统的状态的变化。
到此,以上就是小编对于绝热过程功的公式的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏