本篇目录:
返滴定法是什么呢?
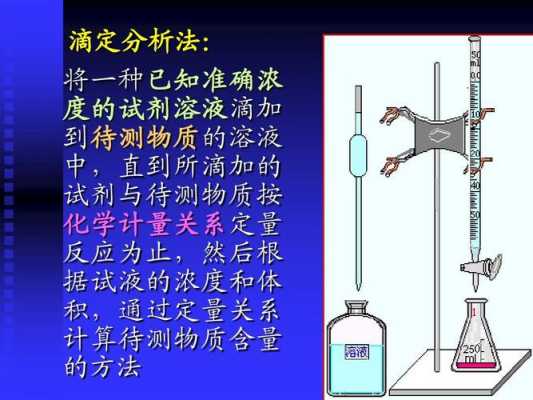
返滴定法(剩余量滴定,俗称回滴):当反应较慢或反应物是固体时,加入符合计量关系的滴定剂,反应常常不能立即完成。此时可以先加入一定量过量的滴定剂A,使反应加速。
返滴定法(剩余量滴定,俗称回滴) 当反应较慢或反应物是固体时,加入符合计量关系的滴定剂,反应常常不能立即完成。此时可以先加入一定量过量的滴定剂,使反应加速。等反应完成后,再用另一种标准溶液滴定剩余的滴定剂。

回滴是一种分析化学技术,用以找出未知浓度反应物的浓度。方法是令该反应物与过量的另一种已知浓度的反应物反应。接着将产生的混合物反向滴定,并须考虑添加过量反应物的莫耳数。
等反应完成后,再用另一种标准溶液滴定剩余的滴定剂。这种滴定方式称为返滴定法。
利用返滴定法用盐酸滴定碳酸钙的方法及反应式
1、在滴定反应中,碳酸钙与盐酸的反应方程式为:CaCO3+2HCl → CaCl2+H2O+CO2。从这个方程式可以看出,1 mol的碳酸钙需要2 mol的盐酸来进行滴定。
2、豌豆大小的碳酸钙,锥形瓶(b)里加入5g 粉末状碳酸钙。各加10mL 水。2 .在两只注射器里各吸入4mL1mol/L 的稀盐酸。量筒里盛满水,倒置在水槽中。3 .同时把注射器内的稀盐酸迅速注入锥形瓶中。
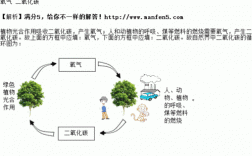
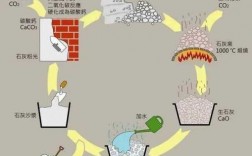
3、一,碳酸钙高温下易分解 CaCO3=CaO十CO2(高温)二,碳酸钙与水,二氧化碳反应 CaCO3十CO2十H2O=Ca(HCO3)2 三,碳酸钙与酸反应。
4、材料 鸡蛋壳。原理 蛋壳钙含量测定:蛋壳的主要成分为CaCO3,将其研碎并加入已知浓度的过量HCL标准溶液,即发生下述反应:CaCO3+HCL=Ca2++CO2↑+H2O。
5、蛋壳中碳酸钙含量的测定为酸碱滴定返滴定法。返滴定法(剩余量滴定,俗称回滴) 当反应较慢或反应物是固体时,加入符合计量关系的滴定剂,反应常常不能立即完成。此时可以先加入一定量过量的滴定剂,使反应加速。
6、盐酸滴定碳酸钙用返滴定法比较好,即加入过量的盐酸标准溶液,和碳酸钙反应完全后,过量的盐酸用氢氧化钠标准溶液返滴定。

返滴定法的原理
1、被测离子发生水解等副反应,影响测定。返滴定法是在一定条件下,向试液中加入已知过量的EDTA标准溶液,然后用另一种金属离子的标准溶液滴定过量的EDTA,由两种标准溶液的浓度和用量,即可求得被测物质的含量。
2、返滴定法(剩余量滴定,俗称回滴) 当反应较慢或反应物是固体时,加入符合计量关系的滴定剂,反应常常不能立即完成。此时可以先加入一定量过量的滴定剂,使反应加速。等反应完成后,再用另一种标准溶液滴定剩余的滴定剂。
3、反滴定法是一种化学分析方法,用于测定溶液中某种物质的浓度。其基本原理是将一种已知浓度的试剂滴入待测溶液中,直到反应完全停止,然后再用另一种试剂滴定剩余的试剂,从而计算出待测物质的浓度。
4、适用情况 返滴定法适用于如下一些情况:被测离子与EDTA反应缓慢。被测离子在滴定的pH下会发生水解,又找不到合适的辅助配位剂。被测离子对指示剂有封闭作用,又找不到合适的指示剂。
什么是返滴定法呀?
返滴定法(剩余量滴定,俗称回滴) 当反应较慢或反应物是固体时,加入符合计量关系的滴定剂,反应常常不能立即完成。此时可以先加入一定量过量的滴定剂,使反应加速。等反应完成后,再用另一种标准溶液滴定剩余的滴定剂。
回滴是一种分析化学技术,用以找出未知浓度反应物的浓度。方法是令该反应物与过量的另一种已知浓度的反应物反应。接着将产生的混合物反向滴定,并须考虑添加过量反应物的莫耳数。
被测离子发生水解等副反应,影响测定。返滴定法是在一定条件下,向试液中加入已知过量的EDTA标准溶液,然后用另一种金属离子的标准溶液滴定过量的EDTA,由两种标准溶液的浓度和用量,即可求得被测物质的含量。
到此,以上就是小编对于反滴定怎么换算含量的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏