本篇目录:
物理化学关于等温循环的功热转换问题
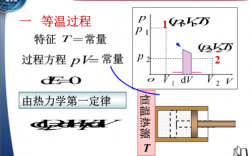
理想气体的内能仅仅是温度的函数,所以等温过程中内能的变化为零。由热力学第一定律得出,理想气体在等温过程中能量转换的特点是Q=A,即系统吸收的热量等于系统对外界所做的功。等温过程是热力学中一种重要过程。
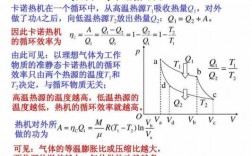
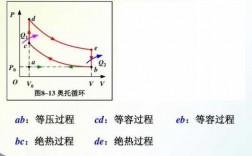
Q1表示循环过程吸收的热量,b→c是等温膨胀过程,气体膨胀对外做工。要保持温度不变,需从外界吸收热量。c→d是等体降压过程,气体压力减小,体积不变,需向外界释放热量。

可逆等温压缩过程中,系统温度和热源的温度时时相等(均为T2),更严格地说,是时时相差无穷小,故传热速率为无穷小。不过这与问题主旨无关,即便是等温膨胀,传热速率也是无穷小,但传热时间是无穷大,故热量不是无穷小。
卡诺循环的四个过程中只有两个步骤有热交换,即两个等温可逆过程,其中高温吸热(Qab)、低温放热(Qcd)。卡诺希望体系所吸收的全部热量Qab全部转换为功,所以定义热机效率为Wnet/Qab。
上式表示,理想气体经过一个正循环,从高温热源吸收的热量Q1,一部分用于对外作功,另一部分则向低温热源放出(如图)。即热量Q1不能全部转换为功W,转换为功的只是Q1-Q2。
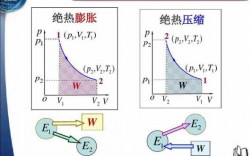
等温可逆过程,温度不变,我们可以认为其热力学能不变。绝热可逆过程,Q=0, 对外做了最大功,会导致热力学能降低,所以温度会降低。这样从相同始态出发,达到相同的体积,必然会有绝热可逆过程的温度低于等温可逆过程。

等温过程中功的变化?
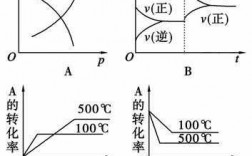
简单地说就是在理想气体的等温过程当中,当气体膨胀,对外作功和吸收的热量都是正的。同时气体从恒温热源吸收的热量,完全用于对外做功。等温过程最重要的是,内能变化为零。、 这样吧,我给你看一道例题,把等温等压等容绝热联系起来。
三种过程系统环境的功和热分别是等压过程、等温过程、绝热过程。等压过程(也称为等容过程):在等压过程中,系统保持恒定的压强,但体积可以改变。此时,系统对环境做功的大小等于PΔV,即系统的压强乘以体积变化量。
等温过程可以对外做功,只要系统对外吸热,也就是说你的问题1是错误的。△E=Q-A,其中△E是系统内能变化,Q为向外吸的热量,A为对外做的功。能满足这个方程就 可以可以实现。
等温可逆膨胀功的公式是 对于理想气体,等温可逆过程:△U=△H=0,W=-nRTlnV2/V1,Q=-W。气体吸收的热量就等于气体对外所做的功。可逆过程是指热力学系统在状态变化时经历的一种理想过程。

在压强不太大,温度不太低的情况下的气体称为理想气体。
范德华气体等温可逆过程的功
等温可逆过程,△U=△H=0,W=-nRTlnV2/V1,Q=-W。可逆过程是指热力学系统在状态变化时经历的一种理想过程。热力学系统由某一状态出发,经过某一过程到达另一状态后,如果存在另一过程,它能使系统和外界完全复原。
对于理想气体,等温可逆过程,△U=△H=0,W=-nRTlnV2/V1,Q=-W。绝热可逆过程:Q=0,△U=W=-P外dV(恒外压)或△U=nCv,mdT,△H=nCp,mdT。可逆过程是指热力学系统在状态变化时经历的一种理想过程。
等温可逆膨胀功的公式是:对于理想气体,等温可逆过程:△U=△H=0,W=-nRTlnV2/V1,Q=-W。气体吸收的热量就等于气体对外所做的功。
对一定质量理想气体等温可逆过程的特征是气体压强P和体积V的乘积不变,PV=恒量。理想气体的内能仅仅是温度的函数,所以过程中内能不变。
到此,以上就是小编对于等温过程怎么求做功的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏