本篇目录:
等体过程温度升高吸热还是放热
等体积升压是吸热。等体积升压,指压强增大而体积不变,那么温度升高,这个过程需要向外界吸收能量,于是属于吸热过程。
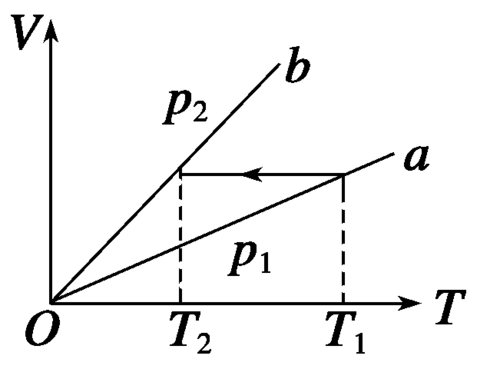
内能变化看温度升高还是降低,升高,内能增大,△U为正。反之则反。等温变化是不变。W看体积变化,体积增大,气体对外做功,W为负,反之则反。等体是不变。
升高温度平衡向着吸热的方向移动。因为在其他条件不变时升高反应温度有利于吸热反应在化学变化中,需要不断吸收大量热量,化学平衡就向吸热方向移动。降低反应温度,有利于放热反应,平衡向放热反应方向移动。
式中Q为热量,正表示系统吸热,负表示放热;C为比热;m为质量;△t为温度变化,△t=t2-t1,所以,温度升高,△t为正,Q也为正的,这一过程为吸热;温度下降,△t为负,Q也为负的,这一过程为放热。
在这个过程中,物体会吸收热量,使自身温度升高。例如,在我们的日常生活中,用火来加热食物或用火炉取暖都是吸热过程。放热是指物体向外界环境释放热能的过程。
等体过程的热力学第一定律是什么
热力学第一定律,也称为能量守恒定律,是热力学中的基本定律,描述能量在系统中的守恒性质。能量守恒原理。热力学第一定律表明,在一个封闭系统中,能量不能被创造或消失,只能从一种形式转化为另一种形式。

热力学第一定律(the first law of thermodynamics)是涉及热现象领域内的能量守恒和转化定律,反映了不同形式的能量在传递与转换过程中守恒。表述为:物体内能的增加等于物体吸收的热量和对物体所作的功的总和。
热力学第一定律数学表达式 △U=Q+W。△U内能的该变量、Q热量、W表示功。表述形式:热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
热力学第一定律是指不同形式的能量在传递与转换过程中守恒的定律,表达式为△U=Q+W。该定律经过迈尔、焦耳等多位物理学家验证,涉及热现象领域内的能量守恒和转化定律。
热力学第一定律(the first law of thermodynamics)就是不同形式的能量在传递与转换过程中守恒的定律,表达式为△U=Q+W。
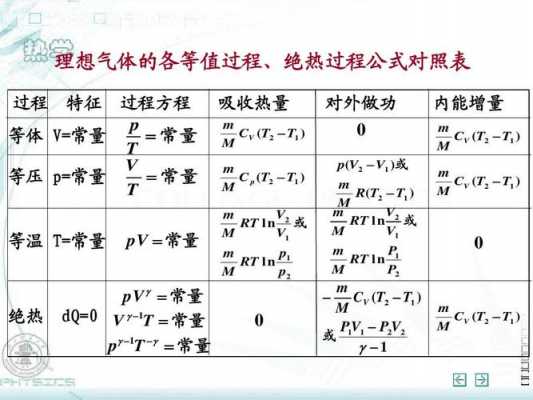
热力学第一定律:热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
1mol理想气体温度升高1K时,在等压过程中比在等体过程中要多吸收多少热量...
1、这句话不正确,应该是小于。说明:气体的内能只由温度决定。定容吸热:假设其升高1k,共吸收Q热量,内能增加为u=Q。定压吸热:先让它等容吸收Q热量,则它会升高1k,那再降到之前的压强,则温度会降低。
2、分别叫做“定压比热”和“定容比热”。定压加热时,气体吸收的热量一方面使气体本身温度升高,另一方面还要克服外力而膨胀作功。因此单位质量的气体温度升高1℃要比定容加热吸收的热量多,也就是说定压比热比定容比热要大。
3、因此,1摩尔氧气温度上升了10K时,在等压过程中,内能的变化ΔU 等于吸收的热量 Q,即ΔU=Q=285J。
4、物体吸收热量的多少跟物体比热容有关。比热容是形容物质吸热能力的物理量。利用比热容的概念可以类推出表示1mol物质升高1K所需的热量的摩尔热容,而在等压条件下的摩尔热容Cp称为定压摩尔热容。
5、的热量称为定压摩尔热容量,以Cp表示;在等容过程中,一摩尔气体温度升高(降低)1k时所吸收(放出)的热量称为定容摩尔热容量以Cv表示。
6、所做体积功等于-R,因为等压过程p不变,且物质的量为1mol,所以V=RT/p,升高1K,则体积V改变量为R/p,而体积功的定义是:-pdV(微分形式),因此体积功的积分值为-R(体系对外做功,所以为负值)。
到此,以上就是小编对于等体过程的过程方程的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏