本篇目录:
- 1、理想气体等温过程中s是什么
- 2、等温过程气体对外做功公式
- 3、等温膨胀过程到底是怎样的一个过程?
- 4、如何判断是等温过程还是等熵过程
- 5、等温过程的功是怎样的?
- 6、理想气体等温过程中的做功方程式如何写出?
理想气体等温过程中s是什么
对于理想气体的等温过程:ΔS = nR ln(V/V)其中,ΔS是熵变,n是摩尔数,R是气体常数(314 J/(mol·K)),V和V分别是初态和末态的体积。
S是熵,deltaS也就是熵变,熵表示一个系统的混乱程度,这个定义其实是比较模糊的,举个简单的例子比如相同条件下一个系统温度上升了,其中粒子运动加快,也就可以说发生了熵增。

U∝T,所以U/S图就等于T/S图。S是熵啊。过程1:等温膨胀,U不变,V增加,熵增;dS=∫Pdv;过程2:绝热膨胀,S不变,V增加,T 下降,U下降;过程4就不说了,分别1和2反过来就是了。
所以等温膨胀时,由于温度不变,因此焓和内能也不变,即焓变和内能变化均为零.理想气体分子只有动能没有势能,等温过程T不变,分子动能不变,等容过程外界不做功,所以分子内能不变:dQ=0,熵变△S=dQ/T=0。
气体等温膨胀△S的变化:理想气体向真空膨胀,温度不发生变化,真实气体向真空膨胀,温度一定降低。理想气体经过恒容无非体积功的过程,有ΔH=nCp,mΔT。(假设Cp,m是常数)。
如果是可逆等温过程,则: Q=TΔS=T(S2-S1),W=Q-ΔU=TΔS-ΔU式中S为系统的熵。如果是理想气体的等温膨胀(或压缩)过程,系统的状态变化满足pV=常数。
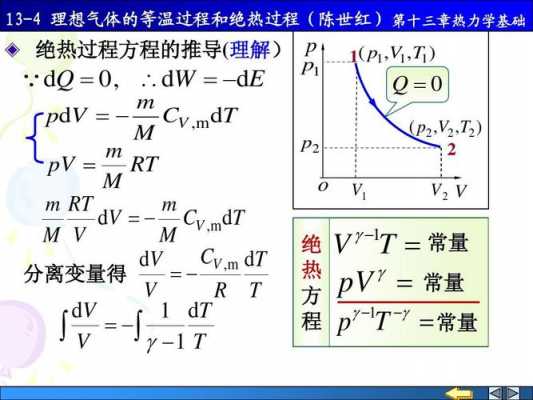
等温过程气体对外做功公式
气体对外界做功公式是W=F*L=P*S*L=PV。气体用力F推着外部某个物体前进一段距离L所做的功。然后力等于压强*面积即单位面积受力乘以面积:F=P*S,而体积等于长度乘以底面积:V=L*S。
根据热力学第一定律,气体的对外做功为 W=nCvΔT,其中Cv为气体的定容摩尔热容,对于双原子理想气体,Cv=5/2R。代入计算可得 W=-33kJ。
理想气体在等温过程中能量转换的特点是Q=A,即系统吸收的热量等于系统对外界所做的功。等温过程是热力学中一种重要过程。卡诺循环就是由两个等温过程和两个绝热过程组成的。物质三态的可逆转变也是在等温条件下进行的。
气体做功公式:当气体等压膨胀时,气体对外做功;当气体等压收缩时,外界对气体做功。计算公式都为 W=p·V。但是在热力学中,规定气体对外做功为正,外界对气体做功为负,所以结果是负的。
等温过程外界做功量W1=-nRT1 ln(V2/V1),内能变化deltaU1=0。多元过程外界做功量W2=(p3V3-p2V2)/(k-1)(该式可用积分证明,该结论可直接使用)内能增量deltaU2=1*Cv(T3-T2)。
等温膨胀过程到底是怎样的一个过程?
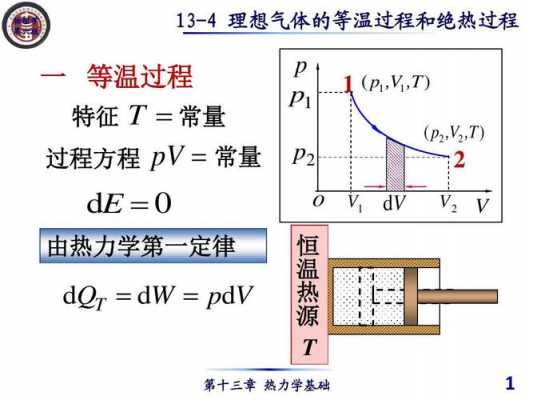
1、等温过程是热力学过程的一种,即是指热力学系统在恒定温度下发生的各种物理或化学过程。在整个等温过程中,热量的传递使系统与其外界处于热平衡状态。
2、温度不变,压力减小。 比如一个针筒,在封闭了的情况下,拉开,这就是一个膨胀过程,如果温度不变,那么就是一个等温膨胀的过程。
3、等温膨胀:所谓等温膨胀就是指一定质量的理想气体在温度不变的条件下缓慢进行的膨胀过程.可见等温膨胀是准静态过程。特征:温度不变,体积增大。
4、从字面上讲,前者是在恒温的条件下进行的,后者是在一个绝热的条件下进行的。在等温可逆膨胀过程中系统对环境做的功比绝热可逆膨胀做的功大。
5、绝热自由膨胀过程中,压强、体积两个量的变化关系的确与等温膨胀中这两个量的变化关系相同,即p2v2=p1v1。定压热容与定体热容的比值称为摩尔热容比,用符号γ表示,大小等于(i+2)/i,其中i是理想气体的自由度。
如何判断是等温过程还是等熵过程
1、绝热膨胀是指与外界没有热量交换,但气体对外界做功,气体膨胀。根据热力学第一定律,可证明这是等熵过程,在这个过程中气体体积增大,压强降低,因而温度降低。
2、绝热可逆过程:就是体系没有热量的散失,且该反映是可逆的过程。可逆的绝热过程是等熵过程。等熵过程的对立面是等温过程,在等温过程中,最大限度的热量被转移到了外界,使得系统温度恒定如常。
3、可逆绝热过程中,每一微小步骤都没有吸热或放热,因此在绝热线上的任意两点间的熵差都是零。故可逆绝热过程就是可逆等熵过程。
等温过程的功是怎样的?
1、简单地说就是在理想气体的等温过程当中,当气体膨胀,对外作功和吸收的热量都是正的。同时气体从恒温热源吸收的热量,完全用于对外做功。等温过程最重要的是,内能变化为零。、 这样吧,我给你看一道例题,把等温等压等容绝热联系起来。
2、等温过程气体对外做功公式:U=U1+U2。等温过程是热力学过程的一种,即是指热力学系统在恒定温度下发生的各种物理或化学过程。在整个等温过程中,热量的传递使系统与其外界处于热平衡状态。
3、三种过程系统环境的功和热分别是等压过程、等温过程、绝热过程。等压过程(也称为等容过程):在等压过程中,系统保持恒定的压强,但体积可以改变。此时,系统对环境做功的大小等于PΔV,即系统的压强乘以体积变化量。
4、等温可逆膨胀功的公式是 对于理想气体,等温可逆过程:△U=△H=0,W=-nRTlnV2/V1,Q=-W。气体吸收的热量就等于气体对外所做的功。可逆过程是指热力学系统在状态变化时经历的一种理想过程。
理想气体等温过程中的做功方程式如何写出?
等温过程气体对外做功公式:U=U1+U2。等温过程是热力学过程的一种,即是指热力学系统在恒定温度下发生的各种物理或化学过程。在整个等温过程中,热量的传递使系统与其外界处于热平衡状态。
等温可逆膨胀功的公式是:对于理想气体,等温可逆过程:△U=△H=0,W=-nRTlnV2/V1,Q=-W。气体吸收的热量就等于气体对外所做的功。
等温可逆膨胀功的公式是 对于理想气体,等温可逆过程:△U=△H=0,W=-nRTlnV2/V1,Q=-W。气体吸收的热量就等于气体对外所做的功。可逆过程是指热力学系统在状态变化时经历的一种理想过程。
到此,以上就是小编对于气体等温过程吸收热量的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏