本篇目录:
高中化学熵变的规律
1、看反应前后气体多少的变化;例如铁和盐酸都不是气体,但生成氢气,熵增;由于气体总量减少,就是熵减;对于化学反应而言,若反应物和产物都处于标准状态下,则反应过程的熵变,即为该反应的标准熵变。
2、高中化学中关于熵变一般不用计算。可以直接用混乱度来考虑熵变,物质分布越混乱熵值越大,由于固体中分子(或原子,离子)排布最有规律,混乱度最小,所以熵值最小,液体次之,气体最混乱,熵值也就最大。

3、一般来说,气体大于液体大于固体,所以生成气体越多,熵变越大。
4、高中化学中关于熵变一般不用计算.可以直接用混乱度来考虑熵变,物质分布越混乱熵值越大,由于固体。中分子(或原子,离子)排布最有规律,混乱度最小,所以熵值最小,液体次之,气体最混乱,熵值也就最大。
5、这些在苏教版化学的一本书后面有表格。活泼金属和非氧化性酸可以发生置换反应,硝酸属于氧化性酸(不管是稀的还是浓的),高中阶段常见的氧化性酸还有浓硫酸。
绝热过程的熵变是什么?
1、熵的变化包括两个部分:一是系统和环境间发生热传导或质量输运,另一部分是由系统内不可逆的热力学过程产生的熵增。如果上述两个部分都不发生,则熵不变。对封闭系统,没有质量输运。对绝热系统,没有热传导。

2、因此,在绝热可逆过程中,熵的改变为0,即△S=0。而不可逆过程是指无法以相反的方式来还原的过程,它通常包括了不可逆的热量交换和能量转换。不可逆过程中热量交换会引起熵的增加,因此熵的改变为正值,即△S0。
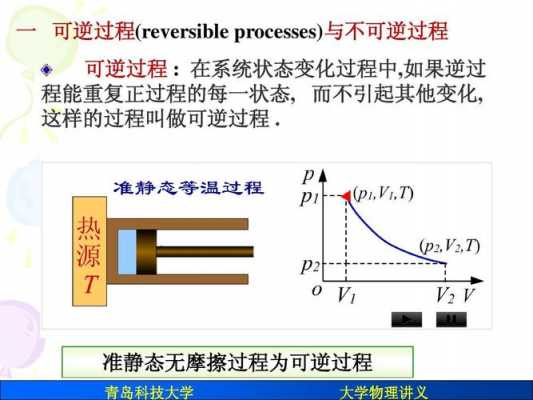
3、熵是一个宏观的状态函数,绝热可逆过程熵变为零。一般来讲,光考虑气体分子热运动的话(不考虑化学反应等等作弊行为),那么准静态的气体绝热过程是可逆的,也就是熵变为零。这里有个前提就是准静态。
4、对于绝热过程Q=0,故S≥0,(因为Q无变化,系统处于无限趋于平衡状态,熵会无限增大,因为平衡状态是理想状态,永远达不到,为ds0。)即系统的熵在可逆绝热过程中不变,在不可逆绝热过程中单调增大。这就是熵增加原理。
5、mA+nB=xC+yD。化学反应而言,反应物和产物都处于标准状态下,绝热反应过程中的熵变计算公式为mA+nB=xC+yD。熵变的标准计算方法是设计为一个等温过程加一个等压过程。
6、因此,在绝热条件下,一切可能发生的实际过程都使系统的熵增大,直到达到平衡态。(参照:多媒体CAI物理化学第四版:大连理工大学出版社)熵增原理是一条与能量守恒有同等地位的物理学原理。
为什么真空蒸发环境熵变不等于系统熵变啊?
1、总熵变=环境熵变+系统熵变 若反应物和产物都处于标准状态下,则反应过程的熵变,即为该反应的标准熵变。当反应进度为单位反应进度时,反应的标准熵变为该反应的标准摩尔熵变,以△rSm表示。
2、向真空中蒸发,w=0;△H=n×Hm=33kJ;因为△H=△U+△(pv)=△U+△nRT;算出△U;△U=Q+W,算出Q。
3、因为熵的计算条件必须是可逆过程,真空箱中确实吸热放热平衡,但是你不能用此时的系统热计算熵变,因为这个过程根本不是可逆过程。实际上真空箱中的熵变和等压过程的熵变是相同的,因为始末态相同。
4、真空膨胀,与沸点时的可逆相变相比,不做膨胀功,系统吸热少。
5、总熵变=环境的熵变+系统的熵变,我们所测出的熵变都是总熵变,因而要严格意义上的测出系统熵变,就要控制环境熵变不变化,或者测出环境熵变后用公式想减得到科学的、有意义的熵变。
6、气体向真空的膨胀过程中,不是平衡态。这种膨胀是不可逆的,熵变大于零。具体计算,可以设计一个准静态过程达到膨胀后的状态,因为熵是状态函数,和过程无关。
到此,以上就是小编对于熵和过程有关吗的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏